Apesar da sua dependência de habitats costeiros (“nearshore”), o que faz com que entre em contacto direto com atividades humanas em toda a sua área de distribuição, o golfinho-corcunda-do-atlântico (Sousa teuszii) é uma das espécies de golfinhos costeiros menos compreendidas. Devido à falta de investigação de campo específica sobre a espécie, existem poucas informações sobre a distribuição, a dimensão da população, a ecologia, o comportamento, a história de vida e a mortalidade do golfinho-corcunda-do-atlântico. As secções que se seguem contêm resumos do que se sabe sobre a espécie, mas os dados apresentam lacunas significativas, além do que grande parte destas informações se baseia em estudos só relativos a um número reduzido de animais.
Descrição
O golfinho-corcunda-do-atlântico tem um corpo de formato robusto, caracterizado por uma bossa de tecido conjuntivo bem visível a meio do dorso. No alto da bossa tem uma barbatana dorsal de extremidade arredondada. Esta espécie tem um bico bem definido, longo e fino; a maxila inferior é de um cinzento mais claro do que a maxila superior. As barbatanas são largas, com um bordo posterior direito e extremidades arredondadas. A coloração geral é o cinzento (podendo parecer cinzento-acastanhado ou preto, dependendo das condições de iluminação), com a pigmentação indo de uma capa dorsal cinzenta-escura a uma superfície ventral e uma garganta cinzentas-claras. Alguns animais têm o pedúnculo caudal cinzento-prateado, coberto por manchas ovais escuras. À volta do olho tem uma mancha num cinzento mais escuro. As crias têm uma coloração do corpo de um cinzento mais claro do que os adultos. O golfinho-corcunda-do-atlântico atinge comprimentos máximos do corpo de cerca de 2,8 m. Os machos adultos são maiores, mais robustos (com um pedúnculo mais profundo), e têm uma bossa dorsal mais pronunciada do que as fêmeas. A bossa e a barbatana dorsal de alguns adultos de maiores dimensões podem estar bordejadas por uma pigmentação branca.

Distribuição
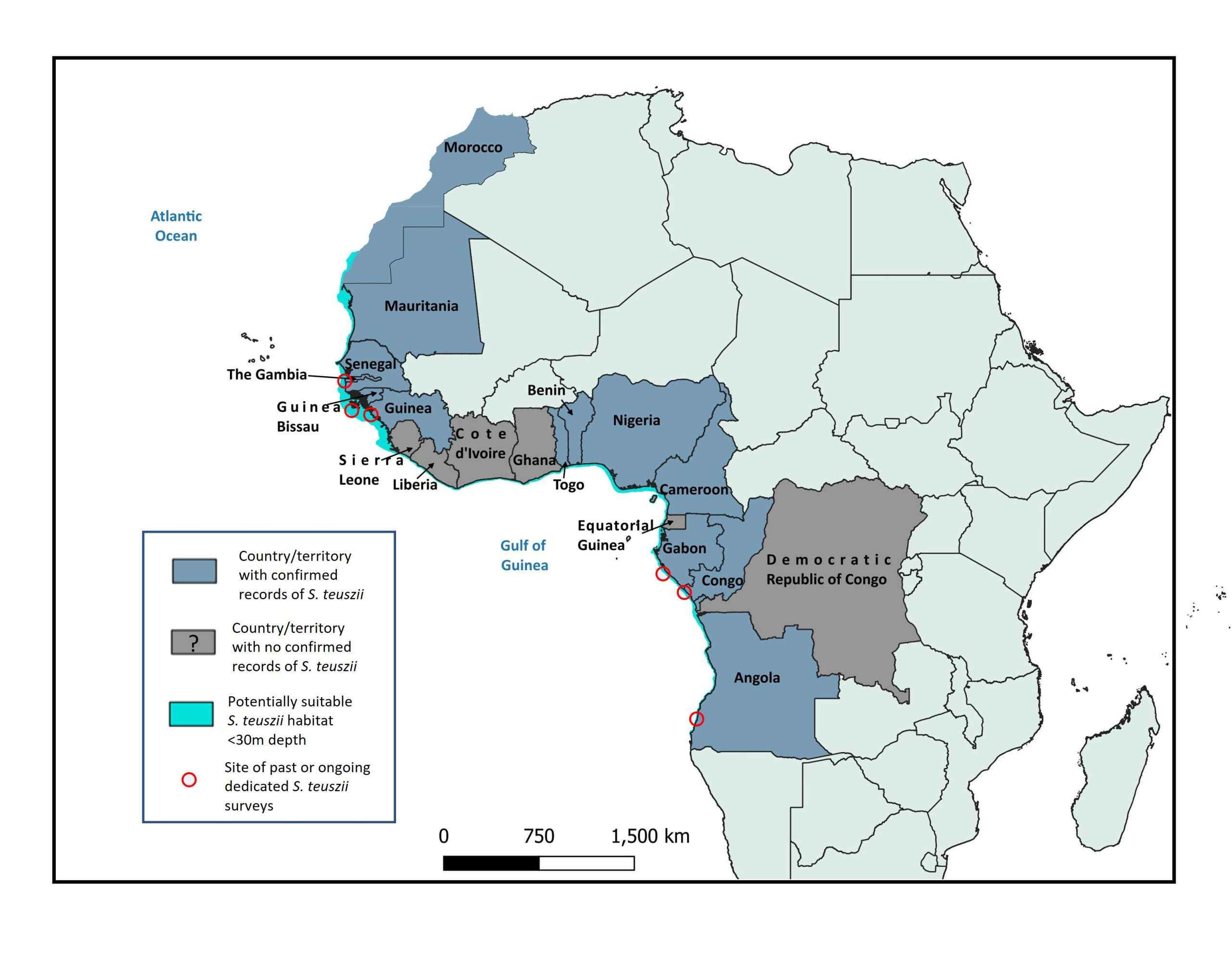
O golfinho-corcunda-do-atlântico é endémico das águas (sub)tropicais ao longo da costa atlântica de África[1-3]. Na maior parte dos países, a sua ocorrência só é conhecida de avistamentos oportunistas, por darem à costa ou de registos de captura acessória. Aliados a um número reduzido de estudos de campo específicos, até à data esses registos documentaram a ocorrência do golfinho-corcunda-do-atlântico em 13 estados das áreas de distribuição, compreendendo (de norte para sul): Baía de Dakhla ao sul de Marrocos; Mauritânia, Senegal, Gâmbia, Guiné-Bissau, Guiné, Togo, Benim, Nigéria, Camarões, Gabão, República do Congo e Angola[1-3]. Os limites latitudinais são 23°54.5’N[4] e 15°38.4’S[5]. A sua ocorrência em seis outros países dentro dessa vasta amplitude latitudinal (Serra Leoa, Libéria, Costa do Marfim, Gana, Guiné Equatorial e República Democrática do Congo) continua por confirmar. Desconhece-se se a ausência ou a escassez de registos em muitos estados, confirmados ou potenciais, das áreas de distribuição se deve a uma falta de esforço de observação e de comunicação, à raridade genuína da espécie, ou se refletem uma área de distribuição descontínua (devido seja a um habitat subótimo, seja a extirpações resultantes de pressões antropogénicas insustentáveis). A espécie não aparece à volta de ilhas costeiras separadas do continente por águas profundas, como a ilha de Bioko.
Abundância
Não existem estimativas fiáveis da dimensão da população de golfinhos-corcunda-do-atlântico em nenhum estado da área de distribuição[1, 2, 6]. Com base em dados esporádicos e “estimativas por adivinhação”, concluiu-se que a abundância total da espécie dentro da sua área de distribuição geográfica pode ser inferior a 3000 animais[1], e foi esse valor que foi utilizado para a avaliação da Lista Vermelha da UICN, em 2017[7]. Além disso, a estrutura da população não foi estudada, e carece de clarificação. A foto-identificação produziu “estimativas mínimas” do número de golfinhos em três áreas de estudo pequenas (por comparação com o comprimento total da linha costeira do país em causa): 103 indivíduos na região do Delta do Saloum, no Senegal[8], 47 animais numa área de estudo de aproximadamente 25 km × 15 km na região do Rio Nunez, no norte da Guiné[9], e 10 animais ao longo de 35 km de costa no sul de Angola[5]. Estes estudos caracterizaram-se por extensões temporais e espaciais limitadas e, com a possível exceção do trabalho realizado em Angola, é pouco provável que tenham sido fotografados todos os animais que utilizam essas áreas. Se bem que haja taxas de encontros disponíveis para alguns estudos (incluindo os mencionados acima e o trabalho realizado no Gabão e na República do Congo[10]), não é possível compará-las diretamente, devido à adoção de métodos diferentes (como, por exemplo, plataformas, extensões das áreas de estudo e estações do ano).

Exemplos de golfinhos-corcunda-do-atlântico individuais com marcas únicas na barbatana dorsal que podem ser utilizadas para fotoidentificação.
Habitat
O golfinho-corcunda-do-atlântico ocupa um conjunto diversificado de habitats costeiros. No presente contexto, entende-se por “costeiro” as áreas em que o leito marinho é afetado pelo movimento das ondas, dando origem a habitats dinâmicos e influenciados pelas marés. Assim sendo, existe um habitat potencial adequado em áreas maiores e mais distantes da costa, em regiões geográficas com leitos marinhos pouco profundos e inclinados, como a área entre o Senegal e a Guiné[3]. Os habitats documentados incluem: sistemas estuarinos grandes (incluindo canais em mangais, águas a montante que sofrem a influência das marés e águas mais afastadas do litoral influenciadas pelos estuários); zonas litorais expostas (frequentemente dento da zona de ressaca ou imediatamente a seguir a essa zona); arquipélagos costeiros; zonas inundadas pelas marés, bancos de areia e bancos de ervas marinhas; e baías grandes e semifechadas[1-3, 11-14]. Ocorrem predominantemente da isóbata de 20 m de profundidade para a linha da costa[3], e frequentemente na parte menos profunda (≤5 m de profundidade) dessa área. Correspondentemente, ocorreram avistamentos confirmados nos 13 km da costa[3], incluindo avistamentos regulares na proximidade imediata da costa[2, 5, 8-11, 14-17]. A sua distribuição mais a norte e mais a sul parece estar largamente limitada a temperaturas médias anuais da água superiores a 15ºC[3].

Exemplos dos diferentes habitats ocupados pelo golfinho-corcunda-do-atlântico, incluindo perto da costa, ao longo de zonas costeiras expostas, vários quilómetros ao largo, em riachos dentro de mangais e em águas turvas sob a influência de estuários.
Alimentação
Sendo um predador marinho, o golfinho-corcunda-do-atlântico pode exercer efeitos ecológicos substanciais “top-down” nos ecossistemas costeiros, em áreas onde as suas populações sejam saudáveis. Não existem estudos específicos sobre a sua alimentação nem as suas interações com espécies presas. Tal como outras espécies Sousa, é provável que o golfinho-corcunda-do-atlântico se possa alimentar de uma grande variedade de peixes bentónicos e pelágicos, espécies cefalópodes e invertebradas, e que haja uma diferença entre espécies presas importantes de área geográfica para área geográfica e de habitat para habitat.
As espécies presas confirmadas durante avistamentos esporádicos ou com base no conteúdo dos estômagos de espécimes capturados acessoriamente incluem: roncadores (Pomadasys spp.), incluindo roncador Pomadasys jubelini[1, 18]; galucha Ethmalosa dorsalis[19]; luciano-da-Goreia Lutjanus goreensis[20]; passarinho Lethrinus atlanticus[20]; efipídeos da África Ocidental Chaetodipterus lippei[20]; serrajão, também chamado bonito ou serra Sarda sarda[5]; tainha Mugil spp.[19, 21], incluindo tainha-da-África-do-Sul Liza richardsonii[5] e tainha-olhalvo Mugil cephalus[8, 21]; rainha-branca Pseudotolithus typus[1]; rainha-senegal Pseudotholithus senegalensis[1]; solhas Paralichthodes e Pseudorhombius spp.[1]; barbudo-real Pentanemus quinquarius[1]; e zagaia-castanheta Squilla mantis[1].

Golfinhos-corcunda-do-atlântico alimentando-se de tainhas em Angola (esquerda) e no Senegal (direita).
Comportamento
Regra geral, o golfinho-corcunda-do-atlântico emerge em movimentos ondulantes calmos, durante os quais muitas vezes o bico se ergue completamente da água e o corpo fica arqueado, acentuando a bossa. Parece ser uma espécie naturalmente discreta, preferindo manter uma certa distância em relação aos motores de embarcações; apesar disso, ocasionalmente salta, “espia” e efetua batimentos caudais. As deslocações e a procura de alimentos constituíram os seus comportamentos dominantes durante os seguimentos especificamente centrados no golfinho-corcunda-do-atlântico[5, 8, 9]. Pode formar grupos para perseguir presas, por vezes emboscando peixes contra a costa[5]. No entanto, também procura alimentos de forma independente, alturas em que os indivíduos se dispersam por uma área maior, emergem de forma imprevisível e, algumas vezes, mergulham de cabeça[5, 8, 9].
Normalmente, o golfinho-corcunda-do-atlântico desloca-se em pequenos grupos; 65% dos avistamentos analisados englobaram 10 animais ou menos, embora tenham sido relatados avistamentos de grupos de até 45 indivíduos[3]. A sua distribuição sobrepõe-se à dos roazes (Tursiops truncatus) em toda a sua área de distribuição, e já foram observadas deslocações das duas espécies em grupos mistos[5, 16]. Atualmente, pouco se sabe acerca das afiliações socias ou da composição idade/sexo dos grupos de golfinhos-corcunda-do-atlântico, embora haja evidências de uma afiliação social forte e de uma estrutura estável do grupo em algumas áreas[5, 9].
A exemplo de outras espécies Sousa, o golfinho-corcunda-do-atlântico é capaz de realizar movimentos espaciais consideráveis, podendo ocupar territórios relativamente grandes. Em Angola foram registadas velocidades de natação de 1 a 7 km/h (média de 4 km/h) durante deslocações ao longo da linha da costa (km lineares)[5]. Foram documentados movimentos transfronteiriços entre alguns estados da área de distribuição[2, 8, 10].

Um pequeno grupo de golfinhos-corcunda-do-atlântico em deslocação ao longo da costa (superior), e exemplos de comportamentos: salto, espreitadela e surfar pelo mar.
Vocalizações
Pouco de sabe acerca dos aspetos acústicos do comportamento do golfinho-corcunda-do-atlântico, mas, tal como outras espécies de golfinhos, esta espécie comunica e deteta o ambiente que a rodeia através de uma combinação de assobios, trens de sons pulsados e estalidos de ecolocalização. O único estudo publicado até à data foi realizado no sul de Angola[6, 22]. Os golfinhos emitiram estalidos de ecolocalização de banda larga, trens de sons pulsados e assobios. Os trens de estalidos caracterizaram-se pela energia mais alta, acima dos 10 kHz, ocorrendo os níveis de energia mais altos na região do limite superior da frequência de 46 kHz do equipamento de gravação, sugerindo que a amplitude de frequência total (e, provavelmente, também o pico de frequência) dos estalidos ultrapassava esse limite. A duração dos trens de estalidos está compreendida entre 0,53 e 37,80 s, com intervalos médios entre estalidos de 43,3 estalidos/s. Os assobios tinham um perfil preponderantemente simples, com mais de 85% com um único ponto de inflexão e, mais vulgarmente, com um perfil convexo ou côncavo[6]. Os valores médios mínimo e máximo da frequência fundamental foram de 4,8 e 8,2 kHz, respetivamente. Esteve presente pelo menos um harmónico em 92% dos assobios, e os harmónicos de vários assobios ultrapassaram o limite de gravação de 46 kHz.
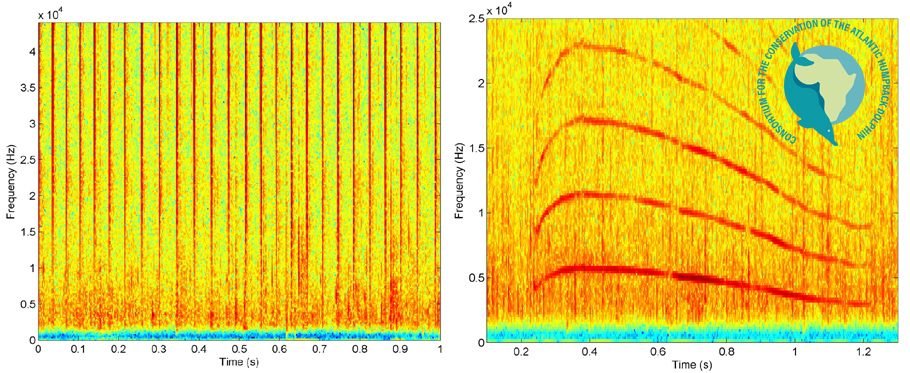
Exemplos de espetrogramas (tempo vs. frequência) mostrando os estalidos de banda larga de ecolocalização (esquerda) e um assobio com a harmónicos (direita) produzidos pelos golfinhos-corcunda-do-atlântico no sul de Angola. Adaptado de Weir (2011).
Parto
Não se sabe muito acerca dos parâmetros de reprodução ou de história de vida do golfinho-corcunda-do-atlântico, embora provavelmente sejam globalmente similares aos de outras espécies Sousa, em que a fêmea atinge a maturidade sexual aos 9-10 anos de idade e produz crias a intervalos de 3 a 5 anos. No sul de Angola nasceu uma cria em finais de abril ou maio[5]. No Delta do Saloum, no Senegal, foi proposto um período de partos durante março e abril[14]; no entanto, foram registadas pelo menos três crias recém-nascidas (e muitas crias mais velhas) no início de novembro[8]. Assim, os partos podem ter lugar ao longo do ano, com picos sazonais, como no caso do golfinho-corcunda-do-índico (Sousa chinensis[23]).

Crias jovens de golfinho-corcunda-do-atlântico ao lado das mães em Angola (esquerda) e no Senegal (direita).
Ameaças
As ameaças humanas e as taxas de mortalidade do golfinho-corcunda-do-atlântico não foram objeto de um estudo sistemático, mas incluem:
Ameaças imediatas que requerem ação
- Captura acessória (acidental) com equipamento de pesca. Foi reportada a morte de golfinhos-corcunda-do-atlântico em resultado de emaranhamento em (principalmente) redes de emalhar artesanais em vários países[1, 2, 13-16, 18, 19, 21, 24-31], tendo sido indicadas taxas de mortalidade insustentáveis na República do Congo[25]. Foram documentadas lesões na barbatana dorsal consistentes com interações com linhas de pesca na Guiné[9]. Mortes em armadilha para peixes[20] e avistamentos de golfinhos-corcunda na proximidade de arrastões[9] indicam a possibilidade de captura acessória noutros tipos de pesca. A captura acessória é amplamente reconhecida como a ameaça imediata mais comum, extensível a toda a área de distribuição, que a espécie enfrenta[1, 2, 15, 28].
- Caça deliberada. A utilização da carne obtida de golfinhos que deram à costa ou de captura acessória (por exemplo, 2, 21, 25, 29) pode evoluir para caçadas dirigidas, nas quais os animais são propositadamente procurados como “carne marinha de animais selvagens” para consumo humano[2, 32-34].
- Perda e degradação do habitat. A deterioração ou a perda do habitat que sustenta os golfinhos ou as suas presas pode ser consequência de várias atividades humanas, incluindo o desenvolvimento da costa (construção de portos, por exemplo), a poluição (contaminantes e escoamentos, derrames de petróleo, plásticos, por exemplo) e a dragagem/arrasto de leitos marinhos.
Ameaças que precisam de ser avaliadas
Estas ameaças afetam globalmente outras espécies de golfinhos, mas é necessária mais investigação para avaliar o impacto que exercem no golfinho-corcunda-do-atlântico:
- Esgotamento de presas, devido a sobrepesca comercial e artesanal.
- Perturbações provocadas pelo turismo, incluindo o número cada vez maior de expedições de observação de golfinhos (no Senegal e na Gâmbia, por exemplo) e o kitesurf (na Baía de Dakhla, por exemplo).
- Perturbações provocadas pelo ruído, incluindo o ruído produzido por embarcações, sonares e pistolas de ar sísmicas.
- Pancadas de embarcações, cujo impacto ainda se desconhece.
- Alterações climáticas, cujos potenciais impactos ainda se desconhecem.
- Capturas de animais vivos, que, de momento, ainda não afetam a espécie.
Fatores intensificadores
A mitigação de potenciais ameaças é prejudicada por fatores como a falta de dados científicos disponíveis sobre, e de sensibilização para, a espécie, a quantidade crescente de pesca ilegal e o elevado grau de dependência da pesca artesanal de comunidades costeiras empobrecidas, tanto para o consumo de proteínas, quanto para a sua subsistência, em toda a área de distribuição da espécie[1, 2, 7, 28]. Algumas das potenciais ameaças podem atuar de forma sinérgica, resultando em impactos cumulativos para as populações. Além disso, a síndrome de mudança da linha de base, em que os valores limite aceites para as condições ambientais estão constantemente a ser baixados pela degradação ambiental progressiva, é, cada vez mais, reconhecida como um obstáculo fundamental à resolução de questões de conservação.

Estatuto de conservação
O golfinho-corcunda-do-atlântico é considerado particularmente vulnerável a pressões antropogénicas, devido: (1) à sua área geográfica restrita; (2) à disponibilidade limitada do seu habitat costeiro (“nearshore”) necessário; (3) à dimensão globalmente reduzida da sua população; e (4) à elevada sobreposição espacial com comunidades humanas costeiras[1, 2, 7, 28]. Esta última é particularmente relevante, dada a pobreza humana generalizada em toda a área de distribuição do golfinho-corcunda-do-atlântico, com uma dependência elevada da pesca com redes de emalhar artesanais tanto para o consumo de proteínas, quanto para a sua sobrevivência. A espécie está incluída na Convention on International Trade in Endangered Species of Wild Flora and Fauna (CITES), Anexo I (espécies ameaçadas de extinção), e desde 2007 que está incluída na Convention on Migratory Species (CMS) Anexo I (espécies migratórias em vias de extinção). Em 2017, o seu estatuto de conservação na IUCN Red List (Lista Vermelha da UICN) foi alterado de Vulnerável para Espécie em Perigo Crítico. Apesar da preocupação crescente dos cientistas e do reconhecimento alargado da possibilidade de redução do estatuto de conservação da espécie ao longo das duas últimas décadas[1, 2, 28, 35, 36], até à data poucos foram os progressos concertados feitos para implementar medidas de gestão da conservação da espécie.

Referências
- Collins T. Re-assessment of the conservation status of the Atlantic humpback dolphin, Sousa teuszii (Kükenthal, 1892) using the IUCN Red List criteria. In: Jefferson TA, Curry BE, editors. Humpback Dolphins (Sousa spp): Current Status and Conservation, Part 1: Advances in Marine Biology. 72: Elsevier; 2015. p. 47-78.
- Van Waerebeek K, Barnett L, Camara A, Cham A, Diallo M, Djiba A, et al. Distribution, status, and biology of the Atlantic humpback dolphin, Sousa teuszii (Kukenthal, 1892). Aquatic Mammals. 2004;30(1):56-83.
- Weir CR, Collins T. A review of the geographical distribution and habitat of the Atlantic humpback dolphin (Sousa teuszii). In: Jefferson TA, Curry BE, editors. Humpback Dolphins (Sousa spp): Current Status and Conservation, Part 1: Advances in Marine Biology. 72: Elsevier; 2015. p. 79-117.
- Beaubrun PC. Un Cétacé nouveau pour les côtes sud-marocaines: Sousa teuszii (Kukenthal, 1892). Mammalia. 1990;54:162-4.
- Weir CR. Distribution, behaviour and photo-identification of Atlantic humpback dolphins Sousa teuszii off Flamingos, Angola. African Journal of Marine Science. 2009;31:319-31.
- Weir CR. Ecology and conservation of cetaceans in the waters between Angola and the Gulf of Guinea, with focus on the Atlantic humpback dolphin (Sousa teuszii): University of Aberdeen, U.K.; 2011.
- Collins T, Braulik GT, Perrin WF. Sousa teuszii (errata version published in 2018): The IUCN Red List of Threatened Species: e.T20425A123792572; 2017 [Downloaded on 08 March 2019].
- Weir CR. Atlantic humpback dolphins (Sousa teuszii) in the Saloum Delta (Senegal): distribution, relative abundance and photo-identification. African Journal of Marine Science. 2016;38:385-94.
- Weir CR. Photo-identification and habitat use of Atlantic humpback dolphins Sousa teuszii around the Río Nuñez estuary in Guinea (West Africa). African Journal of Marine Science. 2015;37:325-34.
- Collins T, Boumba R, Thonio J, Parnell R, Vanleeuwe H, Ngouessono S, et al. The Atlantic humpback dolphin (Sousa teuszii) in Gabon and Congo: cause for optimism or concern? Scientific Committee Report. International Whaling Commission, 2010 SC/62/SM9.
- Notarbartolo di Sciara G, Politi E, Bayed A. A winter cetacean survey off southern Morocco, with a special emphasis on right whales. Reports of the International Whaling Commission. 1998;48:547-50.
- Spaans B. Dolphins in the coastal area of Guiné Bissau. Lutra. 1990;33:126-33.
- Robineau D, Vély M. Les cétacés de Mauritanie (Afrique du nord-ouest). Particularités et variations spatio-temporelles de répartition: rôle des facteurs océanographiques. Revue d’Ecologie (la Terre et la Vie). 1998;53:123-52.
- Maigret J. Donnees nouvelles sur l’ecologie du Sousa teuszii (Cetacea, Delphinidae) de la cote ouest africaine. Bulletin de l’Institut Francais d’Afrique Noire. 1980;42:619-33.
- Ayissi I, Segniagbeto GH, Van Waerebeek K. Rediscovery of Cameroon dolphin, the Gulf of Guinea population of Sousa teuszii (Kükenthal, 1892). ISRN Biodiversity. 2014;2014:6. doi: doi.org/10.1155/2014/819827.
- Leeney RH, Weir CR, Campredon P, Regalla A, Foster J. Occurrence of Atlantic humpback (Sousa teuszii) and bottlenose (Tursiops truncatus) dolphins in the coastal waters of Guinea-Bissau, with an updated cetacean species checklist. Journal of The Marine Biological Association of the United Kingdom. 2016;96(4):933-41.
- Zwart SJ, Weir CR. Filling in the gaps: first record of Sousa teuszii in Benin (Gulf of Guinea: Africa). Marine Biodiversity Records. 2014;7:e59. doi: 10.1017/S1755267214000578.
- Cadenat J, Paraiso F. Nouvelle observation de Sotalia teuszii (Cétacé, Delphinidé) sur les côtes du Sénégal. Bulletin de l’Institut Français d’Afrique Noire. 1957;19:324-32.
- Cadenat J. Rapport sur les petits cétacés ouest-Africains. Résultats des recherches entreprises sur ces animaux jusqu’au mois de mars 195. Bulletin de l’Institut Français d’Afrique Noire. 1959;21:1367-409.
- Sequeira M, Reiner F. First record of an Atlantic humpback dolphin, Sousa teuszii Kukenthal, 1892 (Cetacea; Delphinidae) in Guinea-Bissau. Mammalia. 1992;56:311-3.
- Busnel RG. Symbiotic relationship between man and dolphins. Transactions of the New York Academy of Sciences. 1973;35:113-31.
- Weir CR. First description of Atlantic humpback dolphin (Sousa teuszii) whistles, recorded off Angola. Bioacoustics. 2010;19:211-24.
- Jefferson TA, Smith BD. Re-assessment of the conservation status of the Indo-Pacific humpback dolphin (Sousa chinensis) using the IUCN Red List Criteria. . Advances in Marine Biology. 2015;73:1-26.
- Cadenat J. Notes sur les cétacés observés sur les cötes du Sénégal de 1941 à 1948. Bulletin de l’Institut Français d’Afrique Noire. 1949;11:1-15.
- Collins T, Stindberg S, Boumba R, Dilambaka E, Thonio J, Mouissou C, et al. Progress on Atlantic humpback dolphin conservation and research efforts in Congo and Gabon. Scientific Committee Report. International Whaling Commission, 2013 SC/65a/SM16rev.
- Segniagbeto GH, Van Waerebeek K, Bowessidjaou JE, Ketoh K, Kpatcha TK, Okoumassou K, et al. Annotated checklist and fisheries interactions of cetaceans in Togo, with evidence of Antarctic minke whale in the Gulf of Guinea. Integrative Zoology. 2014;9:1-13. Epub 2014/01/23. doi: 10.1111/1749-4877.12011. PubMed PMID: 24447657.
- Van Waerebeek K, Uwagbae M, Segniagbeto GH, Bamy IL, Ayissi I. New records of Atlantic humpback dolphin in Guinea, Nigeria, Cameroon and Togo underscore fisheries pressure and generalised marine bushmeat demand. Revue d’Ecologie (Terre et Vie). 2017;72:192-205.
- Weir CR, Van Waerebeek K, Jefferson TA, Collins T. West Africa’s Atlantic humpback dolphin (Sousa teuszii): endemic, enigmatic and soon Endangered? African Zoology. 2011;46:1-17.
- Cadenat J. Un delphinidae encore mal connu de la côte occidentale d’Afrique: Sotalia teuszii Kükenthal 1892. Bulletin de l’Institut Français d’Afrique Noire. 1956;18:555-66.
- Cadenat J. Observations de cétacés, siréniens, chéloniens et sauriens en 1955-1956. Bulletin de l’Institut Français d’Afrique Noire. 1957;19:1358-75.
- Bamy IL, Van Waerebeek K, Bah SS, Dia M, Kaba B, Keita N, et al. Species occurrence of cetaceans in Guinea, including humpback whales with southern hemisphere seasonality. Marine Biodiversity Records. 2010;3:e48.
- Alfaro-Shigueto J, Van Waerebeek K. Drowning in the sea of silence: the bushmeat concept applied for marine fauna. Fourth Biennial Zoos and Aquariums Committing to Conservation Conference; 28 November – 2 December 2001; Cocoa Beach, Florida2001.
- Leeney RH, Dia IM, Dia M. Food, pharmacy, friend? Bycatch, direct take and consumption of dolphins in West Africa. Human Ecololgy. 2015;43:105-18.
- Cadenat J. Observations de cetaces au Senegal. Notes Africaines. 1947;34:20-3.
- Jefferson TA. Endangered odontocetes and the social connection: selected examples of species at risk. In: Wursig B, editor. Ethology and Behavioral Ecology of Odontocetes: Springer Nature; 2019. p. 465-81.
- Reeves RR, Smith BD, Crespo EA, Notarbartolo di Sciara G. Dolphins, whales and porpoises: 2002-2010 conservation action plan for the world’s cetaceans. Gland, Switzerland and Cambridge, UK: IUCN/SSC Cetacean Specialist Group, IUCN, 2003.

